Sábado, 12 de Julho de 2025
Sábado, 12 de Julho de 2025
Por Redação Rádio Pampa | 25 de novembro de 2021
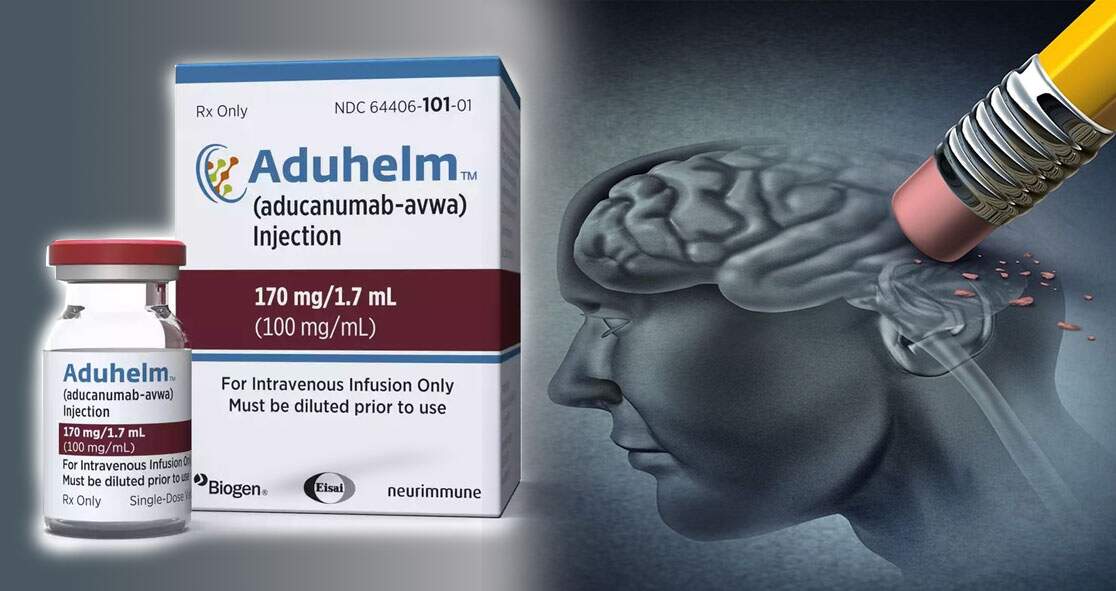
A morte de uma paciente de 75 anos após receber infusões do novo medicamento para Alzheimer aumentou ainda mais as preocupações sobre os riscos de segurança do novo e controverso tratamento. A mulher, que vivia no Canadá, faleceu no final de setembro.
O óbito foi relatado recentemente por um médico ao sistema de notificação de eventos adversos da Food and Drug Administration (FDA), agência que regula medicamentos nos Estados Unidos. O caso está em investigação pela FDA e pela Biogen, empresa fabricante do medicamento, também conhecido pelo nome científico, aducanumabe.
“É preciso cautela pois o caso está em investigação. Ainda não se sabe se a morte da paciente foi causada pelo remédio, mas é possível que sim”, pondera o médico geriatra Otavio Castello, diretor científico da regional Distrito Federal da Associação Brasileira de Alzheimer.
Antes de morrer, a paciente apresentou inchaço cerebral, que é um dos possíveis efeitos colaterais graves do tratamento, assim como sangramentos cerebrais. De acordo com informações do New York Times, entre julho e setembro, três outros casos de hospitalização por anormalidades de imagem relacionadas ao amiloide ou ARIA, síndrome que inclui o inchaço temporário em áreas do cérebro e pequenos pontos de sangramento dentro ou na superfície do cérebro com o inchaço, foram relatados à FDA.
De acordo com o médico, esse é um efeito colateral possível e aceitável do medicamento, desde que em grau leve. Dados de segurança dos testes clínicos do medicamento foram publicados essa semana na revista JAMA Neurology. Os resultados mostraram que 41% dos pacientes que receberam a alta dose do Aduhelm apresentaram inchaço ou sangramento cerebral.
Os principais sintomas relatados foram sintomas dores de cabeça, confusão, tontura e náusea. Menos frequentenmente também foram relatados fadiga, deficiência visual, visão turva e distúrbios da marcha. Em comunicado, a Biogen afirmou que a maior parte desses casos surgiu no início do período de tratamento. Nenhuma morte associada ao problema foi relatada. A paciente que faleceu participava de um estudo de extensão do medicamento, de acordo com a empresa.
O Aduhelm é um anticorpo monoclonal administrado via infusão mensal. O medicamento foi aprovado em junho pela FDA, mesmo após um comitê consultivo de especialistas externos da agência ter contraindicado sua aprovação por julgar que não estava claro se o aducanumabe poderia trazer benefícios clínicos aos pacientes e por preocupações em relação à sua segurança. Isso fez com que a liberação do medicamento tenha sido alvo de críticas e esteja sob investigação.
Para Castello, o caso da morte da participante do estudo clínico é problemático porque aumenta ainda mais a suspeita em relação a um medicamento cuja aprovação já era alvo de insegurança na comunidade científica.
Os dados de eficácia do medicamento vem de dois ensaios clínicos de fase 3 que foram encerrados em 2019 após um comitê de monitoramento independente concluir que o medicamento não trazia melhora clínica aos pacientes, embora conseguisse reduzir a placa de beta-amiloide.
Uma análise posterior da Biogen descobriu que os participantes que receberam a dose mais alta da droga em um desses ensaios, apresentaram uma ligeira desaceleração do declínio cognitivo. Esses foram os dados utilizados pela FDA para aprovação do medicamento.
No Ar: Show de Notícias