Home Brasil Anvisa já recebeu 30 pedidos de registro de autotestes de covid
Por Redação Rádio Pampa | 4 de fevereiro de 2022
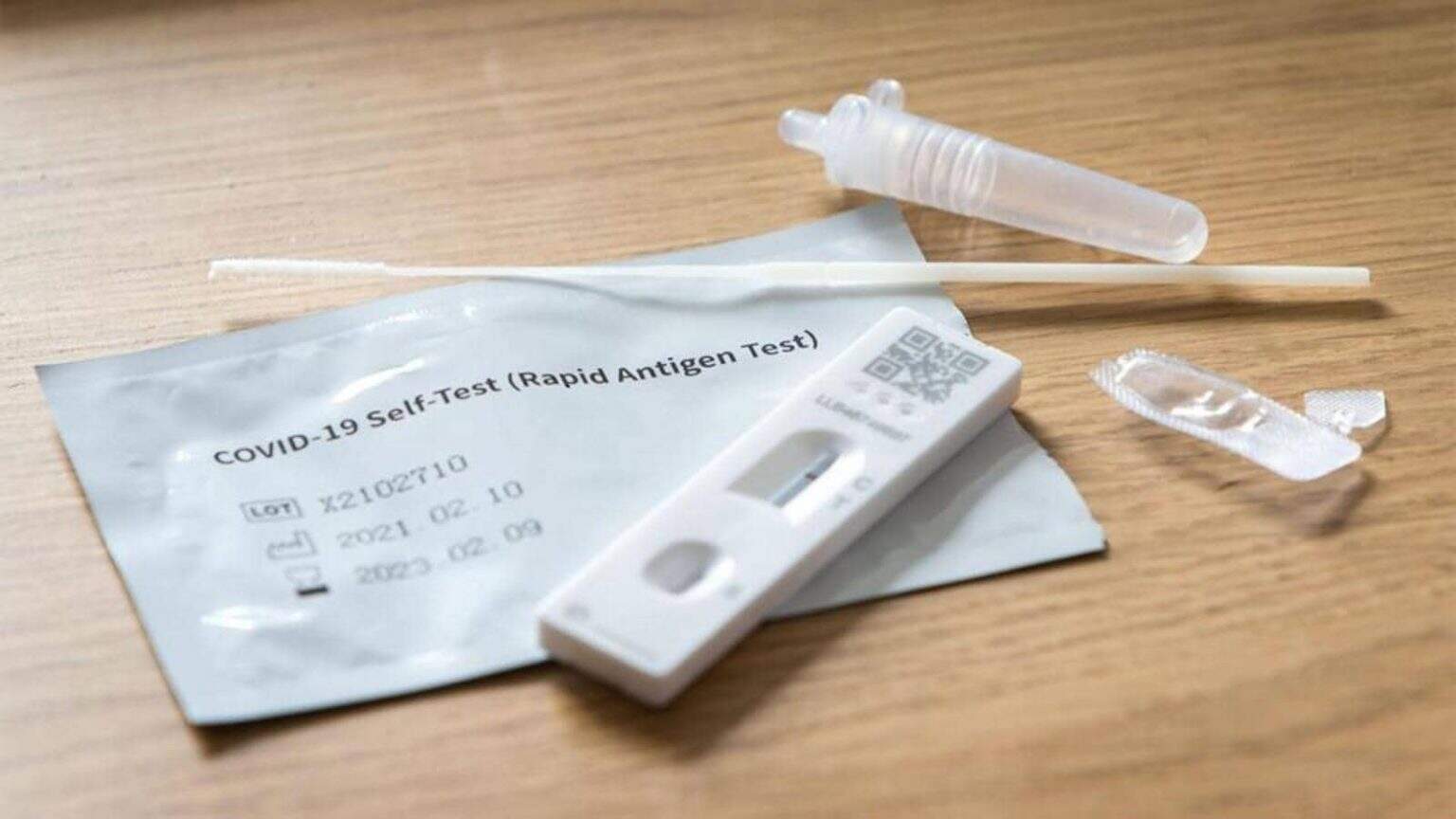
A Agência Nacional de Vigilância Sanitária (Anvisa) já recebeu 30 pedidos de registro para autotestes para covid. As informações estão disponibilizadas em um painel que monitora a entrada de novas solicitações. Ele foi atualizado na manhã dessa sexta.
Três pedidos já foram concluídos e aguardam a publicação no Diário Oficial da União (DOU). Um deles é da empresa brasileira Okay Technology Comércio do Brasil Ltda – ela foi a primeira a solicitar registro da Anvisa, dias após aprovação de venda.
Dois produtos seguem em análise pelos técnicos da Anvisa. Já os outros 25 foram distribuídos para a área responsável, segundo consta no painel da agência.
Os autotestes só poderão ser comercializados no País após registro do produto junto à Anvisa.
O autoteste é parecido com o teste rápido, mas pode ser feito por leigos, em casa. O kit vem com um dispositivo de teste, tampão de extração, filtro e o swab – uma espécie de cotonete usado para a coleta nasal, a mais comum.
O chamado “teste de antígeno” é capaz de identificar o antígeno viral, que é uma estrutura do vírus que faz com que o corpo produza uma resposta imunológica contra ele – os anticorpos.
Os testes de antígeno detectam essas estruturas. Se ele dá positivo, significa que a pessoa está infectada no momento do teste – e pode infectar outras.
Coquetel
A Anvisa anunciou nessa sexta-feira (4) que revogou a autorização de uso emergencial do coquetel de anticorpos monoclonais da Eli Lilly (bamlanivimabe e etesevimabe).
A decisão ocorreu após a reguladora solicitar que a farmacêutica apresentasse dados sobre a efetividade do medicamento diante da variante ômicron. Diante do pedido, a farmacêutica sinalizou que gostaria que a liberação ao uso do fármaco — obtida em maio do ano passado — fosse revogada.
Apesar de ter só agora o uso emergencial suspenso pela Agência, o coquetel de anticorpos monoclonais nunca chegou a ser efetivamente distribuído no Brasil (nem mesmo quando era eficaz para a variante em circulação) de acordo com informações da Eli Lilly.
Na mesma berlinda está outro tipo de medicamento da mesma linhagem, desenvolvido pelas empresas Regeneron e Roche (casirivimabe e imdevimabe). A Anvisa também solicitou às farmacêuticas dados sobre a viabilidade de seu uso diante da variante ômicron, contudo, ainda não decidiu qual será o futuro desse segundo fármaco no Brasil.
Ambos os fármacos foram anteriormente suspensos pela FDA, a agência sanitária dos Estados Unidos, há cerca de duas semanas, por não ter eficiência diante da variante ômicron.